Investigación
Crean un modelo computacional que simula el crecimiento biomecánico de los tumores de mama
El texto se ha copiado correctamente en el portapapeles
Científicos de la Universidad Carlos III de Madrid (UC3M) y de la Johns Hopkins University (JHU) en EEUU han creado un modelo computacional que simula el proceso de invasión de las células cancerosas de tumores mamarios, en función de las características del tejido circundante y de las uniones celulares, entre otros parámetros. Para ello, analizaron el crecimiento de dichos tumores desde una perspectiva biomecánica.
Los investigadores de la UC3M y de la JHU han desarrollado un modelo que permite simular en un ordenador el crecimiento de tumores teniendo en cuenta estos factores, apoyados en modelos experimentales in vitro.
“En este modelo hemos simulado cómo las células de un tumor de mama se multiplican e invaden el tejido a su alrededor, y cómo se reproducen más o menos según cómo de rígido y poroso sea el tejido alrededor o cómo de fuertes sean las uniones de unas células con otras”, explica uno de los investigadores, Daniel García González, Profesor Titular del Departamento de Medios Continuos y Teoría de Estructuras de la UC3M y responsable del proyecto ERC 4D-Biomap.
Según los autores de la investigación, este tipo de modelos permitirán ayudar a predecir el progreso de un tumor en pacientes a partir de las propiedades mecánicas, como rigidez o densidad, del área donde se desarrolla, que se pueden conocer a través de una biopsia o técnicas de imagen.
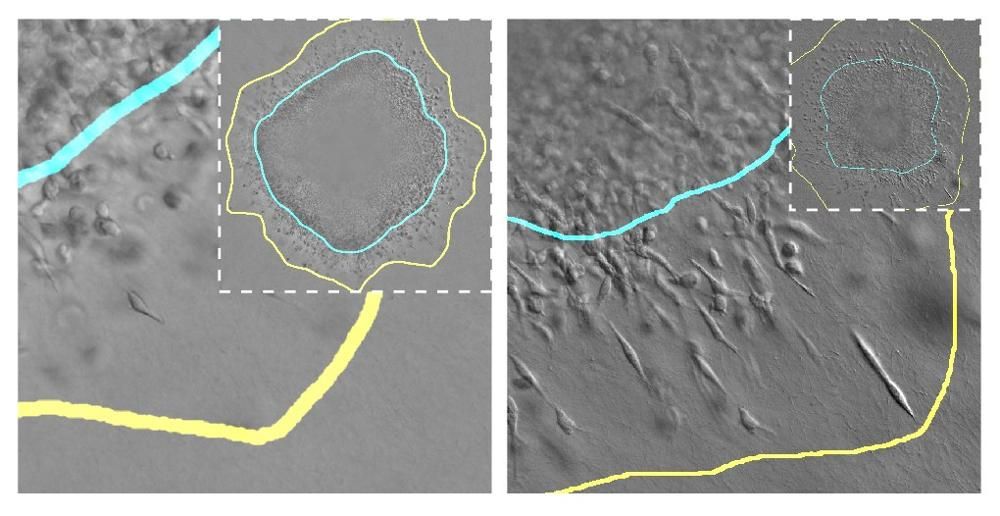
El proceso de crecimiento de un tumor sólido implica su expansión a través del tejido circundante, compuesto habitualmente de una matriz fibrilar (por ejemplo, colágeno). Su expansión depende de muchos factores, como el número total de células del tumor, su volumen y rigidez, su acceso a nutrientes y las propiedades mecánicas del tejido donde se desarrolla.
Para ello, los investigadores han trabajado con esferoides, que son agrupaciones de células tumorales con diferentes características que están embebidas en una matriz y que funcionan como un modelo, simulando cómo se comportan las células en un tumor real.
“Son sistemas muy potentes que se están utilizando cada vez más para hacer estudios sobre el comportamiento de los tumores y también para hacer estudios de posibles terapias”, detalló otra de las investigadoras, Arrate Muñoz-Barrutia, catedrática en el Departamento de Bioingeniería de la UC3M.
Gracias a estos esferoides, los investigadores han podido modificar en el laboratorio ciertos aspectos biológicos o mecánicos de estos tumores y evaluar cómo estas variables influyen en la proliferación y migración de las células.
Posteriormente, han transformado estas observaciones en ecuaciones matemáticas que han incluido en un modelo computacional. De esta manera, podían comprobar en paralelo, tanto en el simulador en el ordenador como en el modelo experimental con los esferoides en el laboratorio, el comportamiento de las variables que afectan al crecimiento de estos tumores.
“Nuestros nuevos esferoides con varios compartimentos nos permitieron controlar y ajustar las propiedades biomecánicas del sistema controlando la densidad de colágeno y la expresión de E-cadherina, que se sabe que desempeñan un papel en la progresión del cáncer de mama. Fue muy emocionante trabajar con este equipo y ver el desarrollo de estos procesos desde perspectivas tanto experimentales como computacionales”, señaló, Denis Wirtz, del Departamento de Ingeniería Química y Biomolecular de la JHU.
“Mientras que experimentalmente la proliferación y la invasión a menudo se miden como dos parámetros independientes, observamos un fuerte acoplamiento de estos procesos. Aunque el análisis de estas contribuciones no se podían desacoplar utilizando aproximaciones experimentales tradicionales, el modelo computacional nos permitió estudiar estos procesos de manera independiente y obtener información sobre las propiedades biomecánicas de nuestro sistema”, destacó la investigadora de la JHU, Ashleigh Crawford.
Según los investigadores, las aplicaciones futuras de este estudio resultan prometedoras. “Si sabemos cuáles son los parámetros mecánicos que afectan a que el tumor crezca más o menos, entonces podríamos utilizar esos datos para mejorar el tratamiento o desarrollar nuevos fármacos a medio o largo plazo”, afirmó Daniel García González.
Para Muñoz-Barrutia, "estos estudios abren las puertas a desarrollos de tecnologías que permitan caracterizar la mecánica del tumor, lo que puede añadir información relevante para la elección de terapia para el cáncer”.
Además, el equipo de científicos también resaltó la importancia de la investigación multidisciplinar en este caso, puesto que se han realizado aportaciones tanto desde el ámbito computacional y matemático hasta el puramente biológico.
(SERVIMEDIA)
20 Mar 2024
CAG/clc



